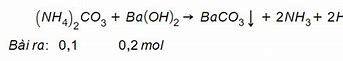
Nh4 2Co3 Ba Oh 2 Pt Ion Rút Gọn
Trong hóa học, tốc độ phản ứng là một đại lượng quan trọng giúp xác định mức độ nhanh chóng của một phản ứng hóa học. Dưới đây là hướng dẫn chi tiết về cách giải dạng bài tập này.
Trong hóa học, tốc độ phản ứng là một đại lượng quan trọng giúp xác định mức độ nhanh chóng của một phản ứng hóa học. Dưới đây là hướng dẫn chi tiết về cách giải dạng bài tập này.
BẢO HIỂM TRÁCH NHIỆM SẢN PHẨM CHO NGƯỜI SỬ DỤNG TRỊ GIÁ 2 TỶ ĐỒNG
Bảo hiểm Quân Đội - MIC cho sản phẩm Thang nhôm Advindeq là bảo hiểm nhằm bảo đảm sự an toàn cho khách hàng khi gặp rủi ro trong quá trình sử dụng thang nhôm. Nếu xảy ra trường hợp có bất kỳ thiệt hại tài sản hay thương tật gây ra bởi sản phẩm thang nhôm Advindeq, người sử dụng hoặc người sở hữu bị thiệt hại sẽ được bồi thường theo quy định.
Bảo hiểm Quân đội MIC: Tổng công ty Cổ phần Bảo hiểm Quân đội - MIC
Sản phẩm được bảo hiểm: Thang nhôm Thương hiệu ADVINDEQ
Phạm vi bảo hiểm: Trách nhiệm pháp lý của người được bảo hiểm trong trường hợp có thương tật hay thiệt hại về người và tài sản cho bên thứ ba phát sinh từ những sản phẩm do người được bảo hiểm cung cấp cụ thể là: Thang nhôm Thương hiệu Advindeq.
Điều kiện và điều khoản: Theo Quy tắc bảo hiểm Trách nhiệm sản phẩm của Quân Đội - MIC (Ban hành theo Quyết định số 137/2006/QĐ-MIC ngày 01 tháng 01 năm 2016 của Tổng giám đốc Tổng công ty Cổ phần Bảo hiểm Quân đội - MIC).
Tổng trị giá trách nhiệm: 2.000.000.000 VND
Bước 1: Xác định phương trình phản ứng hóa học
Đầu tiên, cần xác định phương trình phản ứng hóa học tổng quát. Ví dụ:
Từ phương trình này, chúng ta sẽ phân tích để xác định chất phản ứng và sản phẩm, từ đó tiếp cận đến tốc độ phản ứng.
Bước 3: Tính toán tốc độ phản ứng
Dựa vào biểu thức tốc độ phản ứng, chúng ta có thể thay giá trị nồng độ các chất tham gia phản ứng và giá trị hằng số tốc độ để tính tốc độ phản ứng tại một thời điểm cụ thể.
ĐỀ THI, GIÁO ÁN, GÓI THI ONLINE DÀNH CHO GIÁO VIÊN VÀ PHỤ HUYNH LỚP 12
Bộ giáo án, đề thi, bài giảng powerpoint, khóa học dành cho các thầy cô và học sinh lớp 12, đẩy đủ các bộ sách cánh diều, kết nối tri thức, chân trời sáng tạo tại https://tailieugiaovien.com.vn/ . Hỗ trợ zalo VietJack Official
phuong-trinh-hoa-hoc-cua-canxi-ca.jsp
Đề thi, giáo án các lớp các môn học
Bước 4: Xác định yếu tố ảnh hưởng đến tốc độ phản ứng
Các yếu tố có thể ảnh hưởng đến tốc độ phản ứng bao gồm:
Bước 5: Xử lý các bài toán thực tế
Trong các bài toán thực tế, thường sẽ yêu cầu tính tốc độ phản ứng hoặc dự đoán thời gian cần thiết để phản ứng hoàn thành một phần hoặc hoàn toàn. Dưới đây là ví dụ minh họa:
Ví dụ: Tính tốc độ phản ứng khi nồng độ \(\text{Ca(OH)}_2\) là 0.1 M và \((\text{NH}_4\text{)}_2\text{HPO}_4\) là 0.05 M, với \(k = 0.02 \, \text{M}^{-1}\text{s}^{-1}\).
Thay các giá trị vào biểu thức tốc độ:
Vậy tốc độ phản ứng tại thời điểm đó là \(0.0001 \, \text{M/s}\).
Việc giải các bài toán về tốc độ phản ứng hóa học không chỉ giúp chúng ta hiểu rõ hơn về cơ chế của các phản ứng mà còn hỗ trợ trong việc kiểm soát và tối ưu hóa các quá trình sản xuất trong công nghiệp.
CaO + H2O → Ca(OH)2 | CaO ra Ca(OH)2
Phản ứng CaO + H2O hay CaO ra Ca(OH)2 thuộc loại phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về CaO có lời giải, mời các bạn đón xem:
1. Phương trình phản ứng CaO tác dụng với H2O
Phản ứng trên thuộc loại phản ứng hóa hợp.
2. Hiện tượng của phản ứng CaO tác dụng với H2O
- Phản ứng tỏa nhiệt, sinh ra chất rắn màu trắng, ít tan trong nước.
3. Cách tiến hành phản ứng CaO tác dụng với H2O
- Cho 1 mẩu nhỏ vôi sống CaO vào ống nghiệm, nhỏ vài giọt nước vào Canxi oxit. Tiếp tục cho thêm nước, dùng đũa thủy tinh trộn đều. Để yên ống nghiệm một thời gian.
4. Cách viết phương trình ion thu gọn của phản ứng CaO tác dụng với dung dịch H2O
Bước 1: Viết phương trình phân tử:
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
CaO, tên thông thường là vôi sống, là chất rắn, màu trắng, nóng chảy ở nhiệt độ rất cao (khoảng 2585oC).
CaO có đầy đủ tính chất hóa học của basic oxide.
CaO (r) + H2O (l) → Ca(OH)2 (r)
Phản ứng của CaO với nước gọi là phản ứng tôi vôi, phản ứng này tỏa nhiều nhiệt.
Chất Ca(OH)2 tạo thành gọi là vôi tôi, là chất rắn màu trắng, ít tan trong nước, phần tan tạo thành dung dịch bazơ còn gọi là nước vôi trong.CaO có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
b) Tác dụng với axit tạo thành muối và nước.
Ví dụ: CaO tác dụng với dung dịch hydrochloric acid HCl, phản ứng tỏa nhiều nhiệt, sinh ra canxi clorua CaCl2 tan trong nước.
Nhờ tính chất này, CaO được dùng để khử chua đất trồng trọt, xử lý nước thải của nhiều nhà máy hóa chất, …
c) Tác dụng với acidic oxide tạo thành muối.
Ví dụ: Để một mẩu nhỏ CaO trong không khí ở nhiệt độ thường, CaO hấp thụ khí CO2 để tạo thành canxi carbonate CaCO3.
Vì vậy CaO sẽ giảm chất lượng nếu lưu giữ lâu ngày trong tự nhiên.
CaO có những ứng dụng chủ yếu sau đây:
- Phần lớn canxi oxit được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học.
- Ngoài ra, canxi oxit còn được dùng để khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm, khử độc môi trường,…
- Canxi oxit có tính hút ẩm mạnh nên được dùng để làm khô nhiều chất.
5.3. Sản xuất canxi oxit trong công nghiệp
Nguyên liệu để sản xuất canxi oxit là đá vôi (chứa CaCO3). Chất đốt là than đá, củi, dầu, khí tự nhiên,…
Các phản ứng hóa học xảy ra khi nung đá vôi:
- Than cháy sinh ra khí CO2 và tỏa nhiều nhiệt:
- Nhiệt sinh ra phân hủy đá vôi ở khoảng trên 9000C:
CaCO3 (r) →t0 CaO (r) + CO2 (k)
Câu 2: CaO dùng làm chất khử chua đất trồng là ứng dụng của tính chất hóa học nào?
CaO dùng làm chất khử chua đất trồng là ứng dụng của tính chất hóa học là tác dụng với axit.
Câu 3: Phương trình hóa học nào sau đây dùng để điều chế canxi oxit (CaO)?
A. CaCO3 (r) → CaO (r) + CO2 (k)
B. Ca(OH)2 (dd) → CaO (r) + H2O (h)
C. CaSO4 (r) → CaO (r) + SO2 (k)
D. CaSO4 (r) → CaO (r) + SO2 (k)
Phương trình hóa học dùng để điều chế CaO là: CaCO3 (r) → CaO (r) + CO2 (k)
Câu 4: Cho các oxit sau: CO2, K2O, CaO, BaO, P2O5. Oxit tác dụng với axit để tạo thành muối và nước là
basic oxide tác dụng với axit tạo thành muối và nước.
Câu 5: Nung CaCO3 ở nhiệt độ cao, thu được chất rắn X. Chất X là
CaCO3 →t0 CaO (rắn) + CO2 (khí)
Câu 6: Oxit khi tan trong nước làm cho quỳ tím chuyển thành màu xanh là
Oxit là: CaO khi tác dụng với nước tạo thành dung dịch bazo, dung dịch bazo làm cho quỳ tím hóa xanh.
Câu 7: Phương trình phản ứng khi cho CaO tác dụng với axit H2SO4 là
D. CaO + 4H2SO4 → Ca2(SO4)3 + 2H2O
Phương trình phản ứng: CaO + H2SO4 → CaSO4 + H2O
Câu 8: Hòa tan hết 11,2 gam CaO vào dung dịch HCl 20%. Khối lượng dung dịch HCl đã dùng là
Số mol của CaO là: nCaO = 0,2 mol
CaO+2HCl→CaCl2+H2O0,2 0,4 (mol)
Theo phương trình phản ứng, ta có: nHCl = 0,4 mol
Suy ra khối lượng của HCl là: mHCl = 0,4.36,5 = 14,6 gam
Khối lượng dung dịch HCl đã dùng là: mdd(HCl) = 14,6.100%20% = 73 gam.
Câu 9: Để thu được 5,6 tấn vôi sống với hiệu suất phản ứng đạt 95% thì lượng CaCO3 cần dùng là
A. 9,5 tấn B. 10,5 tấn C. 10 tấn D. 9,0 tấn
Do hiệu suất phản ứng là 95% nên lượng CaCO3 cần dùng là
H%=mltmtt.100%→mtt=mlt.100%H%=10.100%95%=10,5 tấn.
Câu 10: Trong phòng thí nghiệm, oxit nào được dùng làm chất hút ẩm (chất làm khô)?
Trong phòng thí nghiệm, oxit được dùng làm chất hút ẩm (chất làm khô) là: CaO
Vì nó tác dụng với nước tạo thành Ca(OH)2
Xem thêm các phương trình hóa học hay khác: